臍帯血・臍帯資源の提供
臨床用臍帯血・臍帯由来細胞利用申込方法
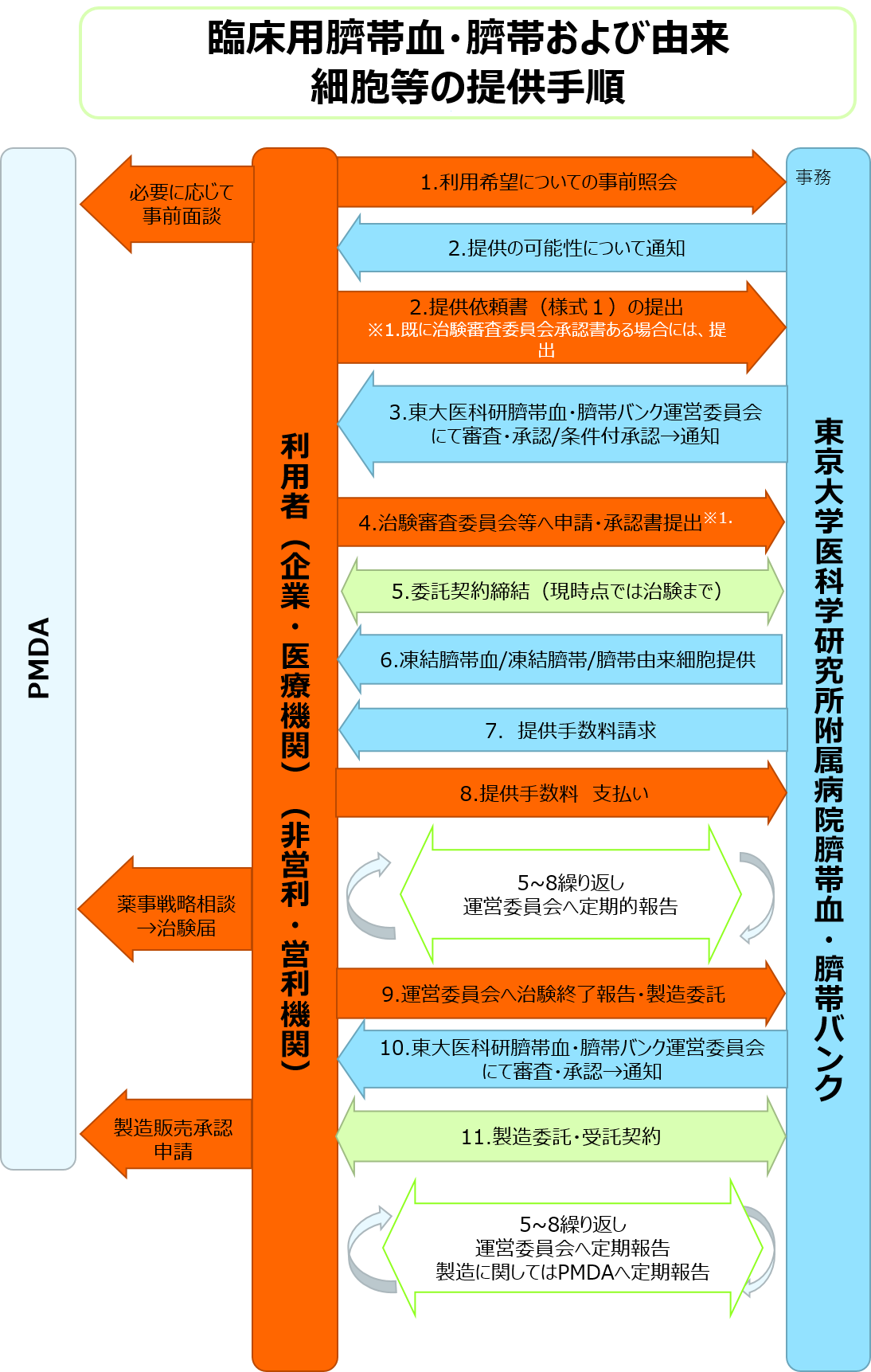
① 臨床用臍帯血・臍帯由来細胞の提供の流れは下図のようになります。提供をご希望の方は利用希望についてまずは直接ご照会ください。
なお、ご希望に沿えない場合がありますのでご了承ください。
② 事前照会の結果、提供の可能性について通知させていただきます。 製造に関するPMDAへの薬事戦略相談には、ご協力させて頂きますが、事前にNDA締結が必要です。また、ノウハウや知財対象の提供に関する部分は、契約・手続きが必要となりますのでご了承下さい。その都度ご相談させていただきます。
③ 下記より様式をダウンロードし、申請してください。申請前に事務局の確認を必ず受けて下さい。治験実施計画書案、治験薬概要書案が必要となります。その他検討が必要な場合には、別途倫理委員会の承認が必要となります。なお、既に治験審査委員会等の承認書がある場合はそちらも添えて提出してください。
④ 申請後、東大医科研臍帯血・臍帯バンク運営委員会(以下、運営委員会)で提供に関する審査(原則対面)があります。 審査の結果、修正・疑義等がある場合には、対応をお願いします。
⑤ 運営委員会にて承認後、MTA契約または委託契約を締結します。
⑥ 必要に応じて治験審査委員会等、実施機関で必要な承認は得ておいてください。
⑦ 凍結臍帯血/臍帯/臍帯由来細胞の提供手数料は製品毎に計算されます。
⑧ 原則的に提供後に提供手数料の請求書が東大医科研担当事務より発行され、お支払い頂きます。但し、提供前の事前検討、調製・培養・試験、その他あまりに高額になる場合には、別途事前に相談させて頂きます。また、計画が大きく変更となった場合も早めにご連絡をお願いします。
⑨治験届が受理された段階で、必ずご一報下さい。治験期間中は、契約書に沿って報告及びご対応お願いします。⑩治験が終了した時点で運営委員会へ治験終了報告の旨ご連絡下さい。
⑪治験以降は、製造委託の申請をしていただき、再度運営委員会にて提供に関する審査を行います。
⑫製造委託・受託契約の締結後に提供を開始します。その他、必要な契約についてはその都度相談させていただきます。